
|
|
|
カテゴリ:カテゴリ未分類
< http://shinichiwanko2000.livedoor.blog/archives/8407460.html >2021年01月16日applications---/wiki/Frontier_molecular_orbital_theory分子軌道{フロンティア軌道と呼ばれる軌道の密度や位相によって、分子の反応性が支配されていることを主張する理論. }, < http://shinichiwanko2000.livedoor.blog/archives/8425222.html >2021年01月18日photochemical光化学過程?? cycloadditions付加環化反応?!? and their stereochemistry原子の空間的配置(立体化学? )---/wiki/cycloaddition かんれん・カモ??・
For nonlinear molecules, the orbital symmetries are not σ or π but depend on the symmetry of each molecule. Water (H2O) is a bent molecule (105°) with C2v molecular symmetry分子対称性{~ 分子に存在する対称性およびその対称性に応じた分子の分類・・・ 分子対称性は化学における基本概念であり、双極子モーメントや許容分光遷移(Laporte ruleラポルテの規則(~ 中心対称の分子(反転中心を持つもの)および原子にのみ適用される分光学的選択則である. ラポルテの規則は、パリティが保存される電子遷移(反転中心に対して対称であっても反対称であっても、すなわち g〔偶〕→ g〔偶〕、あるいはu〔奇〕→ u〔奇〕)は禁制である、と述べる. こういった分子における許容遷移は、(g → uあるいはu → gの)パリティの変化を含まなければならない. 結果として、分子が中心対称であるとすれば任意のp軌道内あるいはd軌道内での遷移(すなわち、任意の亜殻内での電子の再分配のみを含む遷移)は禁制である. 軌道に付けられる記号 gはドイツ語の geradeの略であり、反転中心に関して対称性が存在することを意味する. すなわち、全ての原子を反転中心を通って反転させたとすると、得られる軌道は反転を行う前のものと全く同じとなる. 記号uはドイツ語の ungeradeの略であり、軌道が反転中心に関して反対称であり、反転によっていずれの場所においても符号が変化する. ラポルテの規則は、電子遷移の間にパリティが反転しなければならないとする量子力学における選択律(=選択則!? ) が起源である. しかしながら、対称中心が乱れたとすれば禁制遷移は許され、実際に、こういった一見したところ禁制の遷移は実験で観測される. 対称中心の乱れは、ヤーン・テラー効果や非対称振動といった様々な理由で起こる. 錯体は常に完璧に対称ではない. 分子の非対称振動の結果として起こる遷移は振電遷移と呼ばれる(***vibronic coupling振電相互作用[< https://photosyn.jp/pwiki/index.php?%E6%8C%AF%E9%9B%BB%E7%9B%B8%E4%BA%92%E4%BD%9C%E7%94%A8 >振電相互作用 - 光合成事典 - 日本光合成学会2020/05/12{~ ボルン-オッペンハイマー近似(断熱近似 ) では,分子の全波動関数を互いに独立した原子核の振動の波動関数と電子の波動関数(核の位置をパラメータとして含む)の積として取り扱う.しかし原子核の振動によって電子の波動関数の混合が生じる場合があり,これを振電相互作用と呼ぶ.2つの電子状態がある振動モードを介して振電相互作用をしている場合,その振動モードの振動数は,高エネルギー側の電子状態では押し上げられ,低エネルギー側の電子状態では押し下げられるので,振電相互作用の存在を検出することができる.振電相互作用は,2つの電子状態間の内部転換をひき起こすという意味で重要である.振電相互作用の強さは,その電子状態間の遷移結合次数行列と振電相互作用を媒介する振動モード(Lx)行列の積に比例するので,それらの対称性と位相によって決定される.光合成系carotenoidカロテノイド[< https://photosyn.jp/pwiki/index.php?%E3%82%AB%E3%83%AD%E3%83%86%E3%83%8E%E3%82%A4%E3%83%89 >やくひん?!? ] においては,基底(1Ag-)状態と第一励起(2Ag-)状態の間に共役二重結合の全対称(ag)伸縮振動に媒介される強い振電相互作用が存在し,第一励起状態の極端に高いC=C伸縮振動数と,極端に短い寿命(10-11秒 )の原因になっていることが知られている.} ] を参照 ). こういった非対称振動によって、d → d遷移といった理論的に禁制であるはずの遷移が弱く許される. ラポルテの規則の名称はオットー・ラポルテに因む. ラポルテの規則は、特に遷移金属の電子分光法に関連性がある. 八面体形錯体は(厳密あるいは近似的に )対称中心を持つ. そのため、d → d遷移はラポルテの規則によって禁制であり、極めて弱く観測される. しかしながら、四面体形錯体は対称中心を持たないため、ラポルテの規則は適用されず、より強いスペクトルを持つ. </wiki/ラポルテの規則 > ) といった**selection[or transition ] rule,選択則に基づく[(かんれん, )< https://cse.google.com/cse?ie=UTF-8&q=%E9%81%B8%E6%8A%9E%E5%89%87+site%3Aplaza.rakuten.co.jp%2Ftadashityutyu&cx=002636997843861491696%3Av3cnak5qsac&siteurl=plaza.rakuten.co.jp%2Ftadashityutyu%2F&ref=my.plaza.rakuten.co.jp%2Fdiary%2Fwrite%2F&ss= >選択則 site:plaza.rakuten.co.jp/tadashityutyu ] )といった分子の化学的性質の多くを予測あるいは説明することができる. 多くの大学レベルの物理化学や量子化学、無機化学の教科書は、対称性のために一章を割いている・・ </wiki/分子対称性 > }. The possible orbital symmetries are listed in the table below. For example, an orbital of B1 symmetry (called a b1 orbital with a small b since it is a one-electron function ) is multiplied by -1 under the symmetry operations C2 (rotation about the 2-fold rotation axis ) and σv'(yz) (reflection in the molecular plane分子水準? ). It is multiplied by +1(unchanged ) by the identity operation E and by σv(xz) (reflection in the plane bisecting平面二分?? the H-O-H angle ). The oxygen atomic orbitals are labeled according to their symmetry as a1 for the 2s orbital and b1 (2px), b2 (2py) and a1 (2pz) for the three 2p orbitals. The two hydrogen 1s orbitals are premixed内部混合[素?]?!? to form a1 (σ) and b2 (σ*) MO. Mixing takes place between same-symmetry orbitals of comparable energy resulting a new set of MO's for water: 2a1 MO from mixing of the oxygen 2s AO and the hydrogen σ MO. 1b2 MO from mixing of the oxygen 2py AO and the hydrogen σ* MO. 3a1 MO from mixing of the a1 AOs. 1b1 nonbonding MO from the oxygen 2px AO (the p-orbital perpendicular to the molecular plane ).  <figure - *molecular orbital diagram分子軌道ダイアグラム of water > 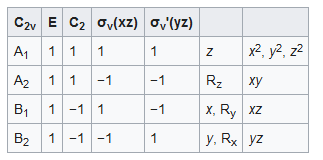 <figure <figure In agreement with this description the photoelectron spectrum for water shows a sharp peak for the nonbonding 1b1 MO (12.6 eV) and three broad peaks for the 3a1 MO (14.7 eV), 1b2 MO (18.5 eV) and the 2a1 MO (32.2 eV)こんなモン、よわい「でんき? 」??. The 1b1 MO is a lone pair, while the 3a1, 1b2 and 2a1 MO's can be localized{局在化分子軌道 - それぞれの分子軌道が二重に占有されている閉殻分子では、局在化および非局在化軌道描写は実質的に等価であり同じ物理状態を表わす. 再び水を例にとると、1つ目の結合に2個の電子を配置し、2つ目の結合にもう2個の電子を配置するのは両方の結合の上を自由に移動できる4個の電子を持つことと同じではないように見える. しかしながら、量子力学では全ての電子は同一であり、「同じ 」あるいは「その他 」と区別することができない. 全波動関数は****スレイター行列式(あるいはスレイター行列式の線形結合{John Clarke Slaterジョン・クラーク・スレイター, (1900年12月22日 - 1976年7月25日)が、さいしょの?! 'programmings "を、COBOL{Common Business Oriented Language(コボル- 共通事務処理用言語 )は、1959年に事務処理用に開発されたプログラミング言語.< https://ja.wikipedia.org/wiki/COBOL > } で・くみあげた(フェルミ粒子からなる多粒子系の状態を記述する波動関数を表すときに使われる行列式である. この行列式は2つの電子(または他のフェルミ粒子 )の交換に関して符号を変化させることによって反対称性の必要条件と、その結果としてパウリの排他原理を満たす. </wiki/スレイター行列式 > ) !?! } )といったパウリの排他原理を満たす形式を持たなければならず、2つの電子が交換される場合、こういった関数は二重に占有された軌道のいかなるユニタリ変換によっても不変であることが示される. <局在化および非局在軌道描写の等価性ーー/wiki/局在化分子軌道(~ 分子の限定された空間領域に集中した分子軌道である. 例としては、結合あるいは*****lone pair孤立電子対{~ 原子の最外殻の電子対のうち、共有結合に関与していない電子対のこと. それゆえ、unshared electron pair非共有電子対 とも呼ばれる. 量子力学的には、電子軌道はエネルギー準位の低いものから占有され、且つ一つの軌道にはスピンの異なる電子しか入ることができない. 電子のスピンは+1/2と-1/2の二種類のみであるので対を成して軌道を占有することになる. 分子軌道上にない電子はその原子のみに属するので、これを孤立電子対と呼ぶ. 有機電子論では反応機構の要素として孤立電子対に独特の役割を想定していたが、量子論を中心とした現代の反応論では「共有結合に関与していない電子対」以上の意味はない. 孤立電子対の電子は金属やルイス酸性物質に配位することが可能であり、孤立電子対を持つ化合物は配位子やルイス塩基として働くことができる. </wiki/孤立電子対 > } がある. 局在化分子軌道は、分子軌道計算と単純な結合理論を関連付けるために使用することができ、電子相関の局所的性質をうまく利用することによってポスト-ハートリー-フォック電子構造計算を迅速化することもできる. 周期的境界条件を持つ系における局在化軌道はワニエ関数{ブロッホ関数 (また、ブロッホの定理[2021年01月28日Bloch's theorem---Bloch's theoremブロッホの定理{"Group theory proof '", 'Another proof '', ~Proof of theorem ~~ それぞれガ、algorithmsとして、いかされて・イル・・・ だから?!、ショウメイが・だいじ !!? } ] を満たす関数をブロッホ関数(またはブロッホ波、ブロッホ状態 )といい、結晶中の電子の一電子状態を表すために用いられる. <ブロッホ関数(定理の内容 )ーー/wiki/ブロッホの定理 > ) のフーリエ変換のこと. </wiki/ワニエ関数 > } として知られている. 標準的な ab initio量子化学法では、一般的に分子全体に拡がり、分子の対称性を有する非局在化軌道が得られる. 局在化軌道は次に非局在化軌道の線形結合として見出すことができ、これは適切なユニタリ変換で与えられる. 例として水分子を挙げると、ab initio計算では結合の特性は主に2つの分子軌道で示される. それぞれは2つの O-H結合間で等しく分布した電子密度を有している. 一方のO-H結合に対応する局在化軌道はこれら2つの非局在化軌道の和であり、もう一方のO-H結合に対応する局在化軌道はこれらの差である. 多重結合と孤立電子対に対して、異なる局在化手法は異なる orbitalオービタルを与える. Boysの局在化法と Edmiston-Ruedenberg局在化法はこれらの orbitalオービタルを混合し、エチレンでは等価な曲がった結合、水では「ウサギの耳 」に似た孤立電子対を与えるのに対して、Pipek-Mezey法はそれぞれの σおよび π対称性を維持する. </wiki/局在化分子軌道 > ) > } to give two O−H bonds and an in-plane lone pair. This MO treatment of water does not have two equivalent rabbit ear lone pairs. 'Hydrogen sulfide (H2S) " too has a C2v symmetry with 8 valence electrons but the bending angle is only 92°. As reflected in its photoelectron spectrum光電子スペクトル as compared to water the 5a1 MO (corresponding to the 3a1 MO in water ) is stabilised (improved overlap ) and the 2b2 MO (corresponding to the 1b2 MO in water ) is destabilized動揺させる、不安定にする、不安定化する (poorer overlap貧困-てき?!「重複、重なり、割込み?!? 」). by Wikipedia {カスカナ、よわい?・ほうしゃのう??がでている H2Oを、ぼくらは・まいにち・のんで・イル !!?・・これで「からだの中のスイソ-engine!? 」が、はたらきだしたら・好都合 ??? } (さんこう, ) https://info.ouj.ac.jp/~hamada/Quantumch/subject/cq/chap5/text/cq980503.html 3.光電子スペクトルからみた分子軌道の性質(ムービー5-8)(パターン5-9) https://www.weblio.jp/content/%E5%85%89%E9%9B%BB%E5%AD%90%E3%82%B9%E3%83%9A%E3%82%AF%E3%83%88%E3%83%AB 光電子分光(光電子スペクトル から転送 ) 出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2020/06/05 05:16 UTC 版) photoemission spectroscopy光電子分光(こうでんしぶんこう、)とは、固体に一定エネルギーの電磁波をあて、光電効果によって外に飛び出してきた電子(光電子とよばれる )のエネルギーを測定し、固体の電子状態を調べる方法である. (かんれん, ) http://shinichiwanko2000.livedoor.blog/archives/8445460.html 2021年01月20日 examples---coordinate covalent, [dative配位結合、半極性結合(与格? ), dipolar] -bond配位 (孤立電子対の電子は金属やルイス酸性物質に配位することが可能であり、孤立電子対を持つ化合物は配位子やルイス塩基として働くことができる. </wiki/孤立電子対 > この世の substance?[material object ]ブッシツのナリタチを、さぐるタビ (しょせん?、computersのヤルことで?!・ここが!?, algorithmsの真[神]髄{物事の中心・精神ともいうべきもの. また、その道の奥義(おうぎ - 学問・芸能・武術などの最も大事な事柄. 最もかんじんな点. 極意. 奥儀. from Weblio ) } [基本!?! ] と、なるトコロ !!? )??? ) etc??, ?!? お気に入りの記事を「いいね!」で応援しよう
最終更新日
2021年01月24日 13時14分52秒
コメント(0) | コメントを書く |